En un reconocimiento que marca un hito en la biomedicina moderna, Mary E. Brunkow, del Institute for Systems Biology (Estados Unidos); Fred Ramsdell, de Sonoma Biotherapeutics (Estados Unidos), y Shimon Sakaguchi, de la Universidad de Osaka (Japón) fueron galardonados con el Premio Nobel de Medicina 2025 por sus revolucionarios avances en la tolerancia inmunitaria periférica, el mecanismo mediante el cual el sistema inmunológico evita atacar el propio organismo, y las células T reguladoras. Su trabajo arroja luz sobre cómo el cuerpo regula la respuesta inmune para no volverse contra sí mismo, abriendo puertas a nuevas terapias para enfermedades autoinmunes, trasplantes y cáncer.
«Sus hallazgos fueron decisivos para entender cómo funciona el sistema inmunitario y por qué no todos desarrollamos enfermedades autoinmunes graves” destacó el profesor Olle Kämpe, presidente del Comité Nobel.
En 1995, cuando la comunidad de investigadores estaba convencida de que la intolerancia inmunológica solo se desarrollaba con la eliminación de nuestro organismo de las células inmunitarias potencialmente dañinas en el timo en un proceso que denominado «tolerancia central», Shimon Sakaguchi dio un avance a contracorriente, al identificar una nueva clase de células inmunitarias, hasta ese momento desconocidas, las llamadas células T reguladoras o T‑regs, capaces de identificar y matar patógenos invasores o células infectadas, reprimir respuestas inmunes excesivas y prevenir el surgimiento de autoinmunidad, es decir que, funcionan como los guardias de seguridad del sistema inmunológico y evitan que las células inmunes ataquen nuestro propio cuerpo.
El descubrimiento de las T-regs reconfiguró la comprensión del sistema inmunológico: ya no bastaba con “depurar” linfocitos peligrosos; era esencial vigilar las respuestas inmunes en los tejidos periféricos, donde el sistema debe discernir constantemente entre amenazas externas, como infecciones, y componentes propios. Las T-regs actúan en ese entorno periférico, modulando las respuestas inmune “sobreexcitadas” que podrían desencadenar afecciones crónicas.
El gen maestro Foxp3: la conexión entre célula reguladora y enfermedad
Descubrir las T-regs fue un gran avance, pero entender cómo funcionan requería identificar sus mecanismos moleculares. Ahí entraron los trabajos de Mary E. Brunkow y Fred Ramsdell, quienes en 2001 hallaron en una cepa de ratones llamados también “ratones scurfy» una mutación que causaba severas enfermedades autoinmunes donde identificaron el gen Foxp3.
Ese gen resultó ser esencial para el desarrollo, mantenimiento y función de las células T reguladoras.
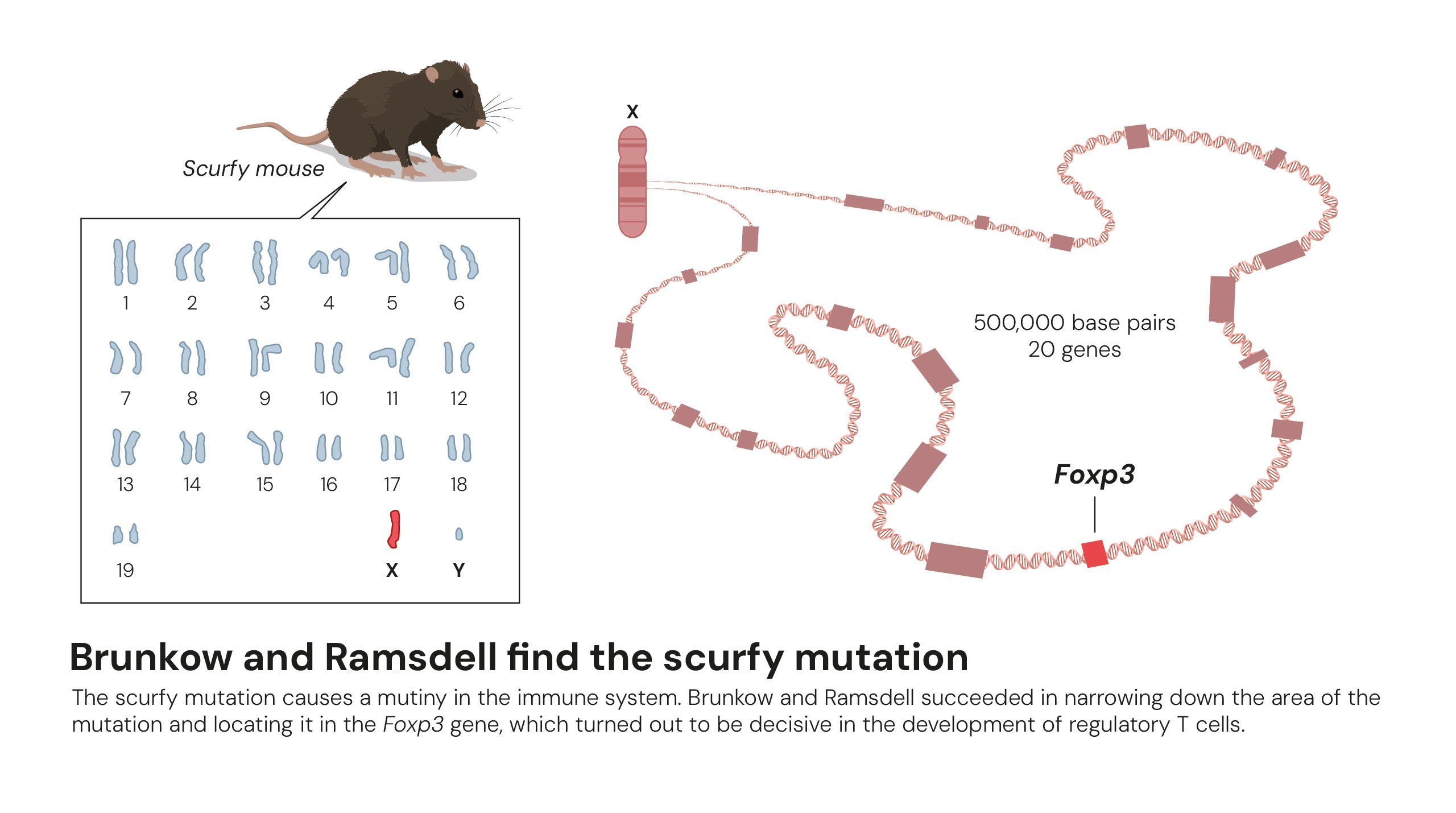
ilustración premios nobel: Brunkow and Ramsdell find the scurfy mutation.
La importancia de Foxp3 va más allá del laboratorio: mutaciones en ese gen en humanos se asocian con el síndrome IPEX, una enfermedad autoinmune rara pero grave que afecta a niños al nacer, que provoca una falla total en la regulación inmunológica..
En 2003, Sakaguchi demostró que el gen Foxp3 dirige el desarrollo de las células T reguladoras, uniendo así las piezas de un rompecabezas que transformó la comprensión del sistema inmunitario, Demostró que el gen Foxp3 controla el desarrollo de las células que él identificó en 1995 y que estas mismas supervisan otras células inmunitarias y garantizan que nuestro sistema inmunitario tolere nuestros propios tejidos.
Esa relación directa entre un defecto genético molecular y una patología clínica concreta consolidó la relevancia médica de los estudios de reguladores inmunitarios. Así, la biología molecular y la inmunología clínica convergieron: el gen Foxp3 funciona como un “interruptor maestro” para prevenir que el sistema inmunitario ataque al propio organismo.
El Comité Nobel reconoció que los tres científicos, aunque trabajaron en laboratorios separados y en momentos distintos, complementaron sus hallazgos de forma esencial: desde la identificación de células reguladoras, hasta la elucidación genética de su función y su impacto clínico en humanos.
Del laboratorio al hospital: implicaciones terapéuticas y futuras preguntas
Los descubrimientos premiados no quedaron circunscritos al ámbito académico: ya están alimentando una nueva ola de terapias inmunológicas. Hoy se están explorando enfoques para manipular o administrar células T reguladoras en el tratamiento de enfermedades autoinmunes como diabetes tipo 1, artritis reumatoide, lupus y otros trastornos donde el sistema inmunitario descontrolado ataca tejidos sanos.
Asimismo, en el campo del trasplante de órganos, la modulación de la tolerancia inmunitaria periférica podría hacer más segura la aceptación de órganos ajenos, reduciendo la necesidad de inmunosupresores agresivos y sus efectos secundarios. En oncología, la capacidad de “apagar” respuestas inmunes excesivas también puede aplicarse a estrategias de inmunoterapia más controladas, donde se busca un balance entre defensa contra células malignas y protección de tejidos sanos.
El impacto ya es visible: múltiples ensayos clínicos en fases exploratorias evalúan la viabilidad de terapias basadas en T-regs modificadas o estimuladas. Aunque los resultados todavía son preliminares, representan un avance tangible hacia una medicina más personalizada, ajustada al perfil inmunológico de cada paciente.
Este premio también reafirma la importancia de la ciencia básica como motor de innovación clínica. La historia de Sakaguchi, Brunkow y Ramsdell recuerda que muchas de las terapias más revolucionarias nacen de preguntas fundamentales sobre cómo funciona la vida, no de demandas inmediatas del mercado.
El reconocimiento será oficializado en Estocolmo el 10 de diciembre, día en que recibirán un premio compartido de 11 millones de coronas suecas (equivalente aproximado a 1,2 millones de dólares), según informó el Comité Nobel. El premio rinde homenaje, además, a la visión integradora que une genética, inmunología molecular y medicina traslacional.
¿Qué sigue para la inmunología? Nuevas líneas de investigación y desafíos
La concesión del Nobel a estos descubrimientos no cierra el capítulo: más bien lo abre. ¿Cómo adaptar estas estrategias en poblaciones con diversidad genética? ¿Cuáles serán los riesgos de manipular el sistema inmune en humanos a gran escala? ¿Podrán desarrollarse tratamientos asequibles para condiciones crónicas en países en desarrollo?
Una pregunta central es cómo equilibrar la estimulación y la supresión del sistema inmunológico: un exceso de regulación puede favorecer infecciones o cánceres, mientras que un déficit desencadena autoinmunidad. En ese sentido, será clave desarrollar métodos que ajusten la función de las T-regs con precisión espacial y temporal.
También queda por explorar cómo estos mecanismos interactúan con otros componentes inmunes: células B, células innatas, microbioma intestinal, metabolismo celular, entre otros. La tolerancia inmunitaria no sucede en aislado; es parte de una red tremendamente compleja.
Finalmente, un aspecto de gran relevancia para América Latina y Colombia es la posibilidad de que este conocimiento inspire programas de investigación autóctona. Invertir en inmunología básica local podría traducirse en beneficios directos en salud pública.
Este reconocimiento no solo celebra logros científicos de talla mundial, sino que añade un nuevo capítulo al diálogo entre la ciencia global y la realidad regional.